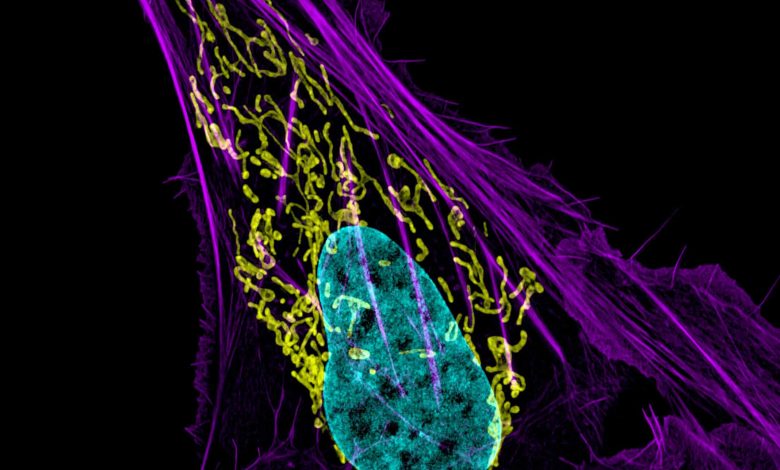
Исследование было сосредоточено на разрушении внутренней мембраны митохондрий, основных производителей энергии, которая питает функции клеток. Митохондрии изображены желтым цветом на изображении выше клетки остеокарциномы. Автор: Дилан Бернетт и Дженнифер Липпинкотт-Шварц, NICHD
Ученые сосредоточились на энергетических центрах раковых клеток — в буквальном смысле — чтобы повредить эти источники энергии и вызвать массовую гибель раковых клеток. В недавнем исследовании исследователи объединили методы для проведения генной терапии, которая нарушает энергию с помощью наночастиц, разработанных специально для воздействия только на раковые клетки.
Испытания показали, что таргетное лечение успешно уменьшает глиобластому головного мозга и агрессивные опухоли молочной железы у мышей.
Исследовательская группа преодолела серьезное препятствие, применив передовую технологию для демонтажа митохондрий — энергетических центров клетки — с помощью метода, который создает активируемые светом электрические токи внутри клетки. Они назвали эту инновационную технологию mlumiOpto.
«Мы разрушаем мембрану, поэтому митохондрии не могут работать функционально, чтобы производить энергию или работать как сигнальный узел. Это вызывает запрограммированную гибель клеток с последующим повреждением ДНК — наши исследования показали, что эти два механизма задействованы и убивают раковые клетки», — сказал соавтор работы Луфан Чжоу, профессор биомедицинской инженерии и хирургии в Университете Огайо. «Именно так эта технология работает».
Митохондрии играют важную роль в качестве «электростанций» клеток, генерируя энергию, необходимую для клеточных функций. В течение многих лет они рассматривались как перспективная цель для противораковой терапии, однако их непроницаемая внутренняя мембрана создавала значительные проблемы.
Пять лет назад лаборатория Чжоу обнаружила способ воспользоваться уязвимостью внутренней мембраны — разницей электрических зарядов, которая сохраняет ее структуру и обеспечивает ее надлежащую функциональность.
«Предыдущие попытки использовали фармацевтический реагент против митохондриально-ориентированных специфических путей активности в раковых клетках», — сказал он. «Наш подход нацелен на митохондрии напрямую, используя внешние гены для активации процесса, который убивает клетки. Это преимущество, и мы показали, что можем получить очень хороший результат в уничтожении различных типов раковых клеток».
Предыдущие эксперименты с клетками продемонстрировали, что белок, способный генерировать электрические токи, может вызывать нарушение внутренней мембраны митохондрий, и исследователи использовали лазер для активации этого светочувствительного белка. В этом последнем исследовании команда разработала внутренний источник света, который имеет решающее значение для адаптации технологии для клинических приложений.
Подход включает введение генетического материала для двух типов молекул: светочувствительного белка CoChR, который генерирует положительно заряженные токи, и фермента, который испускает биолюминесценцию. Эти компоненты инкапсулируются в модифицированную вирусную частицу и доставляются в раковые клетки, что приводит к производству белков, поскольку их гены экспрессируются в митохондриях.
Последующая инъекция определенного химического вещества активирует фермент, который в свою очередь запускает CoChR, что приводит к разрушению митохондрий. Другим важным аспектом этого лечения является обеспечение того, чтобы оно не затрагивало здоровые клетки.
Основой механизма доставки в данном исследовании является хорошо изученный аденоассоциированный вирус (ААВ), представляющий собой минимально инфекционный вирус, предназначенный для транспортировки генов и облегчения их экспрессии для терапевтического применения.
Чтобы улучшить специфичность системы к раку, команда ученых ввела промоторный белок, который увеличивает экспрессию CoChR и биолюминесцентного фермента исключительно в раковых клетках. Кроме того, исследователи разработали AAV с использованием человеческих клеток, инкапсулировав упакованный генами вирус в естественный наноноситель, который имитирует внеклеточные везикулы, которые обычно встречаются в крови и биологических жидкостях человека.
«Эта конструкция обеспечивает стабильность в организме человека, поскольку эта частица получена из линии человеческих клеток», — говорят ученые.
Наконец, исследователи разработали и прикрепили к частице доставки моноклональное антитело, предназначенное для поиска рецепторов на поверхности раковых клеток.
«Это моноклональное антитело может идентифицировать определенный рецептор, поэтому оно находит раковые клетки и доставляет наши терапевтические гены. Мы использовали несколько инструментов, чтобы подтвердить этот эффект. После создания AAV с раково-специфическим промотором и раково-таргетирующей наночастицей мы обнаружили, что эта терапия очень эффективна для лечения нескольких видов рака».
Исследования, проведенные на мышиных моделях, показали, что подход генной терапии значительно уменьшил размер опухоли по сравнению с нелечеными животными в двух быстрорастущих, трудно поддающихся лечению видах рака: глиобластома мозга и трижды негативный рак молочной железы. Помимо уменьшения размера опухоли, лечение также продлило выживаемость мышей, пораженных глиобластомами.
Исследовательская группа изучает дальнейшие потенциальные терапевтические эффекты mlumiOpto для глиобластомы, трижды негативного рака груди и других видов рака. Предварительная патентная заявка на технологии уже была подана Университетом Огайо.